原创丨药物化学前沿
进程[1, 2]
2011年3月,Epizyme公司与日本药物公司卫材(Eisai)签署协议,共同开发靶向EZH2的抗癌药物;
2015年3月,Epizyme与卫材修订合作协议,卫材负责EZH2抑制剂在日本的开发和商业化,Epizyme负责EZH2抑制剂在全球其他地区的开发和商业化;
2019年05月30日,Epizyme开发的表观遗传药物,“first-in-class”EZH2抑制剂Tazemetostat向FDA递交上市申请;
2019年11月5日,卫材以3.3亿美元转让Tazemetostat给皇家医药公司(Royalty Pharma)(除日本以外的全球版权);
2020年1月23日,全球首个EZH2抑制剂Tazemetostat获美国FDA批准,用于治疗16岁及以上患有转移性或局部晚期不可切除的上皮样肉瘤患者。
Tazemetostat与Epizyme
Tazemetostat是一种高活性高选择性的表观遗传药物,其抑制的EZH2(组蛋白甲基转移酶)是一种组蛋白甲基转移酶,如EZH2出现异常,可能导致控制细胞增殖的基因失调,从而引起非霍奇金淋巴瘤,及其他多种实体瘤细胞的无限生长。Tazemetostat主要通过抑制histone H3 lysine 27 (H3K27)甲基化,进而下调EZH2酶活性发挥抗肿瘤作用。
Epizyme于2007年创办伊始仅2位员工——2002年诺贝尔生理/医学奖获得者,麻省理工学院教授Robert Horvitz,美国北卡罗来纳大学教授,霍华德.休斯研究所研究员(施一公被邀请后因全职回国婉拒)张毅。两人在表观遗传学领域均为领军人物。
仅4年时间,2011年,Epizyme获选全球范围内生物医药/制药领域全球最佳工作企业。
生物中的“魔法甲基”
表观遗传学领域的主要研究重点是翻译后修饰(Post-translational modification, PTMs)。在众多PTMs中,组蛋白的赖氨酸/精氨酸残基甲基化显得尤为重要。其中,精氨酸可以被单/双甲基化,而赖氨酸可以被单/双/三甲基化。不同位点的甲基化及不同的甲基化程度会引发不同的效应。可能与基因表达的激活、延伸或抑制有关。这凸显了甲基化途径在细胞功能中的重要性,以及其在靶向治疗中的巨大潜力。
化学中的“魔法甲基”
众多文献报道过“魔法甲基”效应,在化学骨架的“正确”位置添加单个甲基会导致明显的活性增强/减弱。实际上,甲基只能通过弱的伦敦分散力和对亲脂性的适度影响来影响小分子的效力。此外,特定位置甲基的添加也可以通过形成空间位阻,进而“驱使”小分子形成特异性的优势构象,借此增强活性。
图1 苗头化合物
Kevin W. Kuntz等[3]通过高通量筛选发现了苗头化合物1(IC50 = 3.4 + 0.9 μM),受此结果激励,他们再次进行化合物1的类似物筛选,得到了活性低于1μM的小分子5(表1)。
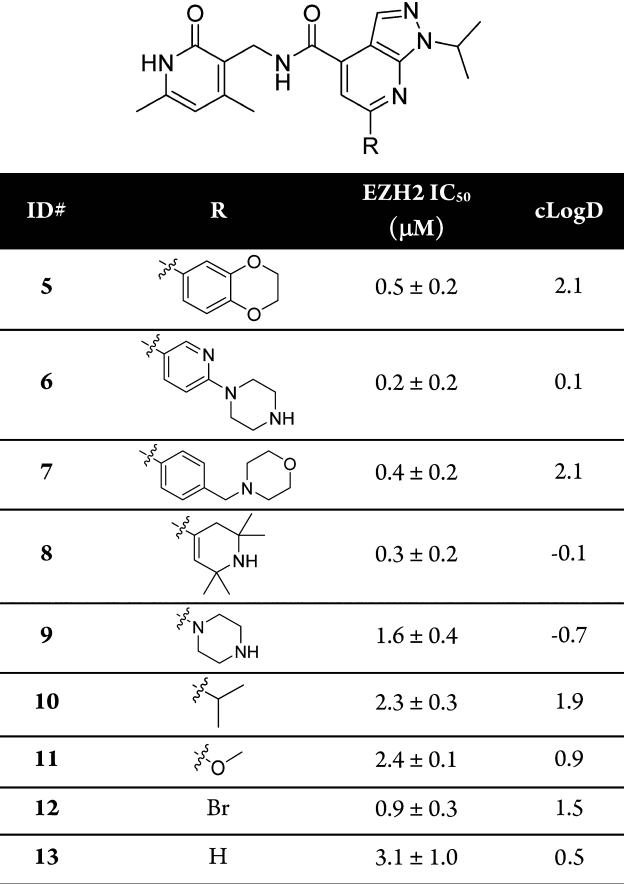
表1 引入极性取代基优化溶解性
但是得到的苗头化合物溶解度有限(pH= 7, <10μM),且生物利用度极低(F=0.5%),因此首先引入极性取代基优化其溶解性(表1),但是未能发现理想的先导化合物。并且,因为去除可溶性取代基仅仅导致生化效能的微弱降低,且为了后续合成与讨论的简单化,在R处保留Br与H。
随后,五元并六元环核心的优化得到优选的4位取代苯并吡唑(表2,14),固定该优选核心。基于之前对吡唑并吡啶系列的优化(图2),研究者发现,吡啶N1上的取代对活性影响极大,活性随着取代基体积的增大而增加,因此使用不同的取代基替换吡唑上的异丙基(表3)。
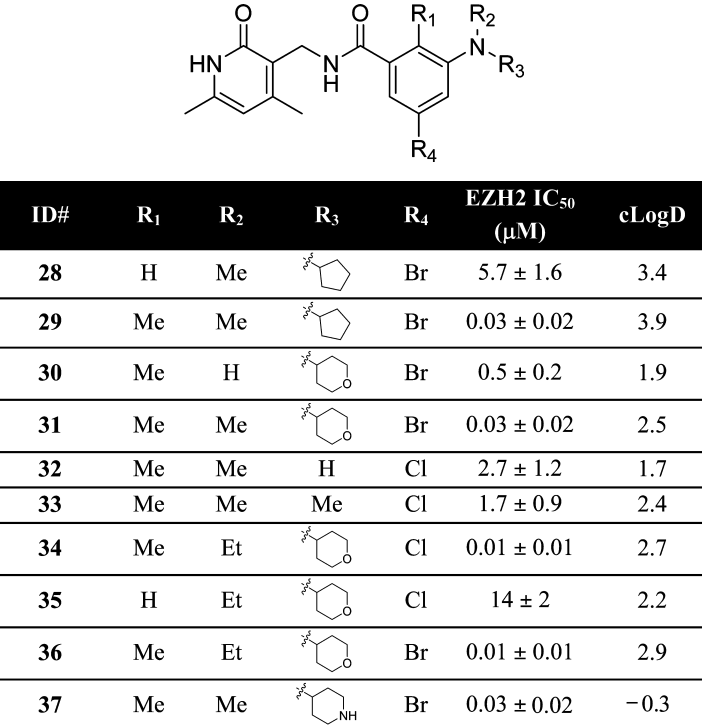
表4 拆分五元并六元环
但以上优化活性未得到明显改善,因此研究者决定后退一步,重新评估五元并六元环作为核心的合理性。将五元并六元环“拆分”,得到取代的苯胺,而苯胺可以很方便的引入不同取代基来改善小分子的活性或药代动力学性质(表4)。在此,R1处“魔法甲基”的威力得以体现(28对比29,35对比36)
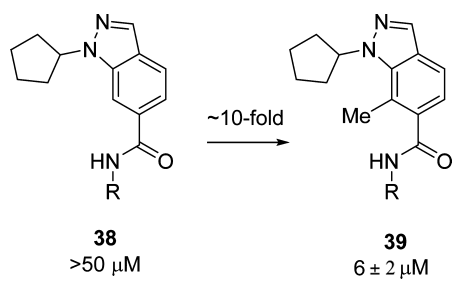
图3 魔法甲基的再次验证
研究者为了在此验证“魔法甲基”效应,重新选用苯并吡唑作为核心母核,在酰胺键附近引入/去掉甲基,两者活性相差十倍左右(图3)。
尽管优化的化合物活性得到提高,但PK性质依然不够理想(表5),研究者考虑是否高极性的苯甲酰胺基甲基吡啶酮对吸收产生不利影响,因此研究者引入甲基封锁其氢键供体(图4)。但是该修饰大大降低了活性。因此研究者尝试仅仅修饰吡啶酮4,6位置的取代(表6)。
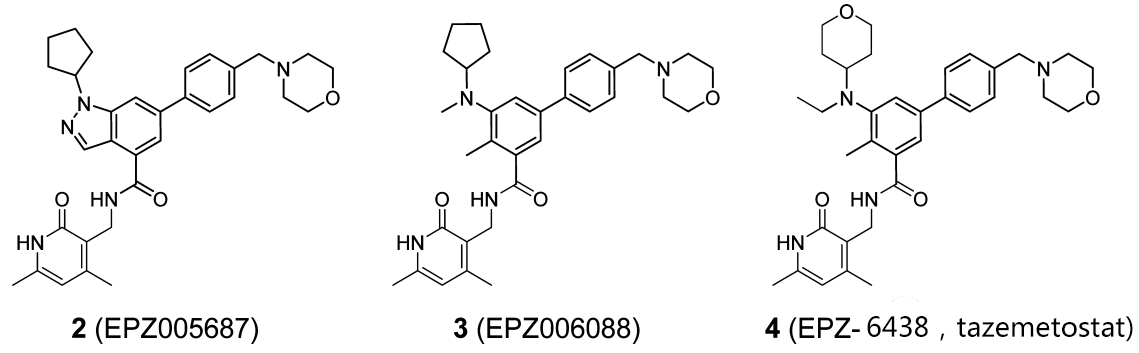
图5 神奇的苄基吗啉
意识到完整的苯甲酰胺基甲基吡啶酮对活性保持至关重要后。研究者尝试其他部位的修饰以提高化合物体内PK。将苄基吗啉引入苯环上甲基对位(卤素占据位置),最终得到了活性与体内PK均较好的系列优选化合物(图5,表5),Tazemetostat身在其列。
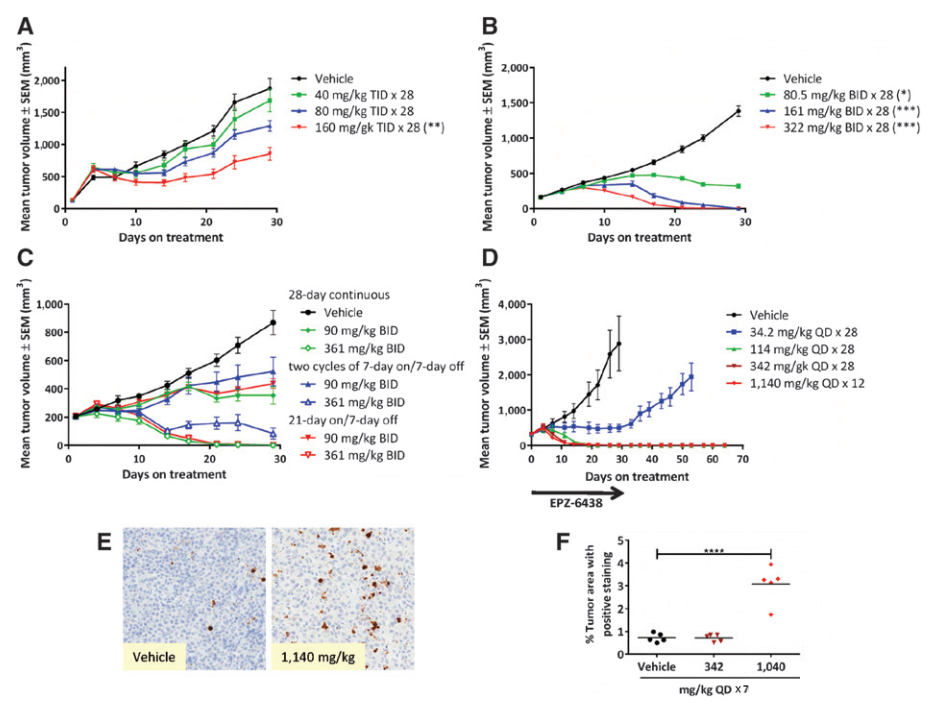
Tazemetostat抗肿瘤丨一图胜千言[4]
总结
在Tazemetostat的发现过程中,出现了四个关键的甲基位置,其中三个位置甲基的引入导致活性提高10-20倍,另一个位置甲基的添加增强了活性> 100倍,当四个甲基同时加入,活性惊人地提高了> 100000倍。这也从侧面反映了高通量筛选发现EZH2抑制剂的难度,因为往往一个甲基的变化就导致活性的急剧变化。
同时也提醒我们,在考虑化合物的多样性时,要记住,甲基,特别是芳基环上的甲基,会对活性产生深远影响。
展望
表观遗传药物,如HDAC抑制剂,IDH抑制剂为大家所熟知,是一个越来越受关注的抗肿瘤药物研发领域。由于对癌症治疗的巨大需求和对资本的追逐,Tazemetostat的上市必将促使医药工作者对于表观遗传药物的研发前赴后继。
参考文献
[1]Epizyme Submits New Drug Application to the U.S.FDA for Tazemetostat for the Treatment of Patients with Follicular Lymphoma.
https://www.businesswire.com/news/home/20191218005788/en/Epizyme-Submits-New-Drug-Application-U.S.-FDA.
[2]TAZVERIK(Tazemetostat) Approved for the Treatment of Epithelioid Sarcoma, Availablefrom Onco360. https://www.firstwordpharma.com/node/1695975.
[3]Kevin W. Kuntz,et al. The Importance of Being Me: Magic Methyls, Methyltransferase Inhibitors,and the Discovery of Tazemetostat, J. Med. Chem. 2016, 59, 1556−1564.
[4]Knutson S K, etal. Selective inhibition of EZH2 by EPZ-6438 leads to potent antitumor activityin EZH2-mutant non-Hodgkin lymphoma, Molecular cancer therapeutics,2014, 13(4): 842-854.


